- SPINELLES
- SPINELLESLe groupe des spinelles est composé d’oxydes doubles répondant à la formule générale MO 練M 23 ou MM 24. Le métal bivalent M peut être Mg, Fe, Zn, Mn, Co, Ni, et le métal trivalent M Al, Fe, Cr, V, Ga, In. Par ailleurs, des métaux quadrivalents peuvent entrer dans la composition des spinelles naturels tels que Ti et Ge. Une grande variété de composition existe dans la nature; les remplacements isomorphiques sont nombreux, mais les ions bivalents à grand rayon ionique tels que Ca, Ba, Sr, Pb et les ions monovalents Na et K n’entrent pas en tant que constituants majeurs dans la composition de ces minéraux. On divise le groupe des spinelles naturels en trois séries d’après la nature de l’élément trivalent: spinelles alumineux , spinelles ferrifères , spinelles chromifères (cf. tabl.). La plupart sont cubiques, de groupe spatial Fd 3m , avec 8 moles par maille; les cristaux ont surtout un faciès octaédrique. Du point de vue structural, les ions oxygène forment très approximativement un assemblage du type cubique compact à faces centrées, les cations occupant des sites octaédriques et tétraédriques de ces assemblages. Cette particularité de la structure explique des propriétés telles que l’isotropie optique, l’absence de clivage, les propriétés magnétiques et électriques, par exemple. La maghémite 塚Fe23 et l’ulvöspinelle (Fe22+Ti4+4) ont une structure type spinelle, de même que la hausmannite MnMn24, de symétrie quadratique. Certains des composés définis dans le tableau sont rares dans la nature; en revanche, il existe de nombreuses solutions solides entre ces composés. Un grand nombre de représentants ont été préparés synthétiquement, ainsi que les solutions solides, et les domaines de stabilité en fonction de la température et de la fugacité de l’oxygène (f 2) ont été précisés.Les spinelles se rencontrent fréquemment comme minéral accessoire dans les roches plutoniques, métamorphiques et volcaniques, et également comme minéral détritique, dans de nombreux sédiments. La magnétite, en particulier, est très fréquente dans les roches ignées, les spinelles alumineux dans les roches métamorphiques et les spinelles chromifères dans les roches basiques et ultrabasiques.StructureLa structure du spinelle proprement dit MgAl24, dont les autres minéraux du groupe sont isostructuraux, a été décrite par W. H. Bragg et S. Nishikawa en 1915. Le groupe spatial est Fd 3m . La maille unité, correspondant à huit moles, a pour arête a = 0,809 nm. Les ions Mg2+ sont placés dans la maille comme les atomes de carbone dans le diamant, c’est-à-dire aux sommets et au milieu des faces, d’une part, et au centre de quatre des huit petits cubes d’arête a /2 pris tétraédriquement, d’autre part. Chacun des quatre petits cubes dont le centre n’est pas occupé par un ion magnésium renferme quatre ions aluminium placés tétraédriquement sur les demi-diagonales joignant le centre du petit cube à ses quatres sommets vides de matière. Chaque ion magnésium est entouré de quatre ions oxygène. Les tétraèdres d’oxygène qui entourent les ions magnésium placés au centre des quatre petits cubes sont inversement homothétiques des tétraèdres d’aluminium. Les tétraèdres d’oxygène qui entourent les ions magnésium placés au sommet et au centre des faces sont homothétiques des tétraèdres d’aluminium (fig. 1). La conséquence de cette distribution des ions oxygène est que chaque ion aluminium est entouré de 6 ions oxygène formant un octaèdre. Les ions oxygène constituent un assemblage du type cubique compact (cf. FERRITES, fig. 1); dans cet assemblage, les ions magnésium sont placés dans des cavités tétraédriques et les ions aluminium dans des cavités octaédriques.L’assemblage compact des ions oxygène n’est pas tout à fait régulier; cela est dû au fait que les ions Mg2+ ont un rayon ionique trop grand pour occuper un site tétraédrique et dilatent le tétraèdre d’oxygène qui les entoure.Dans l’assemblage cubique compact d’oxygène, la moitié des lacunes octaédriques est occupée par Al3+ et le huitième des lacunes tétraédriques par les Mg2+: il y a deux fois moins d’Al3+ et quatre fois moins de Mg2+ que d’oxygène. La maille du spinelle contient 64 sites tétraédriques et 32 sites octaédriques; 24 sites seulement sont occupés: 8 tétraédriques et 16 octaédriques.Bien que l’ion Al3+ soit plus petit que l’ion Mg2+, il occupe dans la structure des positions à coordinance plus élevée. En réalité, les spinelles de ce type sont l’exception: on les appelle les spinelles «normaux». C’est le cas de FeAl24, ZnAl24. Certains spinelles ont une structure «inverse»: la moitié des ions trivalents sont dans des sites tétraédriques, l’autre moitié et les ions bivalents sont répartis dans les sites octaédriques; il en est ainsi pour Fe2+Fe23+4 (magnétite) et en général pour les «ferrites», c’est-à-dire les spinelles où l’ion trivalent est Fe3+. Enfin, certains spinelles ont une structure «mixte», où les deux types de cations occupent à la fois des sites tétraédriques et octaédriques; pour rappeler la distribution des cations dans la maille unité, on écrit entre parenthèses les ions en position octaédrique et avant la parenthèse les ions en position tétraédrique; par exemple: Mg2+(Al3+ 練 Al3+)4 (spinelle normal); Fe3+(Fe2+ 練 Fe3+)4 (spinelle inverse); Fe3+ size=1旅漣x Mgx 2+(Mg2+ size=1旅漣x 練 Fe3+ size=1旅+x )4 (spinelle mixte).À la suite d’une étude générale de tous les types connus (synthétiques et naturels), E. J. W. Verwey et E. L. Heilmann ont formulé un certain nombre de règles semi-empiriques pour la localisation des cations dans les sites:– les ions Al3+ et Ti4+ se trouvent toujours dans les sites octaédriques;– les ions Zn2+ occupent toujours les sites tétraédriques, et les ions Fe3+ de préférence les sites tétraédriques;– les ions Mg2+, Fe2+, Mn2+ se répartissent entre les sites laissés libres par l’application des deux règles précédentes.Les spinelles alumineuxSpinelle proprement ditÀ la structure du minéral MgAl24 qui vient d’être décrite (spinelle normal) correspond la forme octaèdre111 et beaucoup plus rarement le rhombododécaèdre110. La macle (111), dite «macle des spinelles», est fréquente. La densité, variable de 3,5 à 3,7, est la plus faible du groupe. Il existe une série continue de solutions solides entre le spinelle proprement dit MgAl24 et l’hercynite Fe2+Al24; lorsque le rapport Mg/Fe2+ varie de 1 à 3, le minéral est connu sous le nom de pléonaste . Il existe également une série continue de solutions solides entre MgAl24 et la chromite Fe2+Cr24 (magnésiochromites ). Le spinelle est rarement incolore; il peut être diversement coloré et utilisé comme gemme (dureté 8).Le pléonaste n’est pas stable en présence de quartz; il se produit, d’après G. M. Friedman, les réactions suivantes:
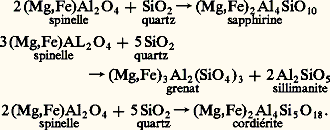 C’est un minéral de haute température commun des roches métamorphiques. Il est souvent associé à la forstérité, au diopside, à la chondrodite et à la phlogopite dans les calcaires métamorphiques, à la cordiérite et aux orthopyroxènes dans les roches argileuses pauvres en silice ayant subi un métamorphisme thermique.HercyniteL’hercynite (Fe2+Al24) a des caractères cristallographiques analogues au spinelle proprement dit avec un paramètre a égal à 0,816 nm. Le système FeAl24 (hercynite)-Fe34 (magnétite) a été étudié expérimentalement par A.C. Turnock en 1959. Au-dessus de 858 0C, il existe une série complète de solutions solides; au-dessous de cette température, deux domaines d’exsolutions apparaissent.Les cristaux d’hercynite sont noirs et se trouvent dans des sédiments argileux métamorphisés plus riches en fer que ceux qui ont donné les pléonastes; on rencontre aussi ce minéral dans les bauxites ferrugineuses métamorphisées, dans des roches basiques et ultrabasiques. On peut également trouver de l’hercynite dans des granulites, ce spinelle ferreux étant stable en présence de silice libre, contrairement au spinelle alumineux magnésien. Les exsolutions d’hercynite dans la magnétite sont fréquentes dans des roches basiques.Gahnite et galaxiteLa gahnite ZnAl24 a une structure de spinelle normal. Il existe probablement une série complète de solutions solides entre ZnAl24 et MgAl24, donnant toutes les compositions que l’on trouve dans les gahnites des pegmatites granitiques ou dans les gîtes zincifères de Franklin (New Jersey) et de Falun (Suède).La galaxite Mn2+Al24 est un minéral rare associé à la téphroïte, à la rhodonite et aux oxydes de manganèse dans certains gisements manganésifères.Les spinelles ferrifèresMagnétiteLa magnétite Fe2+Fe23+4 a une structure du type «spinelle inverse» avec un paramètre a = 0,839 nm; sa formule structurale s’écrit donc, d’après la convention définie plus haut: Fe3+(Fe2+ 練 Fe3+)4.Les moments magnétiques des ions Fe3+ et Fe2+ sont respectivement 5 et 4 magnétons de Bohr. Tous les moments en site tétraédrique sont parallèles entre eux, ceux en site octédrique de même, et les études de diffraction neutronique ont montré que les moments magnétiques de cations en site tétraédrique et en site octaédrique sont antiparallèles suivant [111]. Autrement dit, le réseau des ions magnétogènes est subdivisé en deux sous-réseaux, aimantés en sens inverse, ceci confirme le travail de Néel en 1948. Si les moments étaient égaux dans les deux sous-réseaux, le moment résultant serait nul, et l’on aurait une substance antiferromagnétique. Dans le cas de la magnétite, le moment résultant est: face=F0019 轢5 (face=F0019 良4 練 良5) = 4 magnétons de Bohr, correspondant à une aimantation à saturation de 93 u.é.m. C.G.S.; c’est un ferrimagnétique typique dans le sens de L. Néel [cf. FERRITES ET GRENATS]. La température de Curie est de 578 0C, elle correspond au passage de l’ordre ferrimagnétique, à longue distance et température faible, au désordre quand la température augmente. Ce sont les deux propriétés fondamentales de cette espèce du point de vue magnétique.À l’état naturel, la magnétite pure est assez rare; plus généralement, on rencontre des magnétites substituées (des ions Fe2+ peuvent être remplacés par des ions Mg2+, des ions Fe3+ par Al3+ et Cr3+) et des solutions solides entre la magnétite et l’ulvöspinelle (titanomagnétites ), la magnétite et la maghémite (titanomaghémites ), la magnétite et la hausmannite. Les cristaux courants (cf. MINÉRALOGIE, pl. III) sont de faciès octaédriques111, mais, le plus souvent, la magnétite se présente en masses granulaires d’un noir de fer avec éclat submétallique, de densité 5,2 et de dureté 5.C’est un élément ubiquiste des roches ignées et métamorphiques. Dans les gîtes métallifères, elle existe en concentrations importantes dans les skarns à grenat, à pyroxènes et grenat (Magnitnaïa dans l’Oural) et en amas dans des séries métamorphiques (Kirunavaara en Suède).Les produits d’altération sont, suivant les conditions, la goethite, la lépidocrocite, la limonite, l’hématite ou la maghémite [cf. OXYDES ET HYDROXYDES NATURELS].UlvöspinelleL’ulvöspinelle Fe22+Ti4+4 est un spinelle du type inverse avec Fe2+ et Ti4+ remplaçant 2 Fe3+. On n’a pas observé jusqu’ici des cristaux isolés de ce minéral dans les roches et les minerais, mais il se présente en exsolutions, dans la magnétite, visibles seulement au microscope, aux forts grossissements (de l’ordre de 600). Sa première synthèse a été réalisé par T. Barth et E. Posnjak en 1932. Le paramètre de la maille varie suivant les auteurs, la valeur la plus probable étant 0,853 nm. L’ulvöspinelle est paramagnétique à 20 0C et devient antiferromagnétique aux basses températures, le point de Néel étant de 漣 150 0C. Ce minéral peut s’altérer en ilménite ou en un mélange de magnétite, d’ilménite et de fer.MaghémiteLa maghémite 塚Fe23 a, comme la magnétite, une structure de spinelle inverse. Le réseau des ions 2- est identique à celui des autres spinelles, ce qui conduit à écrire sa formule, en mettant 4 en évidence: Fe3+8/34; ou bien, en spécifiant les sites tétraédriques et octaédriques: Fe3+(Fe3+5/3 練 撚 1/3)4, le symbole 撚 indiquant une vacance. Le réseau est donc lacunaire, les sites vacants étant préférentiellement localisés dans les cavités octaédriques, d’après des études aux rayons X confirmées récemment par une diffraction neutronique. La maghémite est métastable et se transforme irréversiblement en hématite lorsqu’on la chauffe; cette température d’inversion, variable suivant les auteurs, semble dépendre de l’histoire antérieure de l’échantillon. Un point de Curie de 675 0C est obtenu en extrapolant les valeurs formées par des solutions solides stabilisées par la présence d’ions Na+. L’aimantation à saturation à 20 0C serait de 76 u.é.m. C.G.S. Le paramètre de la maille varie de 0,830 à 0,835 nm selon les auteurs.TitanomagnétitesLa magnétite et l’ulvöspinelle peuvent former une série complète de solutions solides à haute température. Cette série a été obtenue synthétiquement par divers chercheurs. On peut écrire sa constitution sous la forme x Fe2Ti4-(1 漣 x )Fe34. Plusieurs modèles coexistent actuellement concernant la distribution des cations. Les variations du paramètre de la maille et du point de Curie en fonction du pourcentage en molécules de Fe2Ti4 sont données sur la figure 2. Les dimensions de la maille augmentent linéairement en fonction du pourcentage en molécules de Fe2Ti4 depuis 0,840 nm (magnétite) jusqu’à 0,853 nm (ulvöspinelle).La composition chimique des titanomagnétites homogènes extraites des roches n’est pas toujours en accord avec la droite idéale des titanomagnétites synthétiques du diagramme ternaire des compositions moléculaires FeO, Fe23, Ti2 (fig. 3). Dans la majorité des cas, elle est comprise entre cette droite et la droite FeTi3-Fe23. Ces titanomagnétites se caractérisent par des sites vacants dans le réseau d’oxygène de structure «spinelle».Les titanomagnétites sont des constituants importants de certaines roches volcaniques, des gabbros et, d’une manière générale, des roches basiques et ultrabasiques. Le plus souvent, la teneur en Fe2Ti4 de la titanomagnétite d’une roche est d’autant plus élevée que la roche est plus basique.Magnésioferrite et frankliniteLa magnésioferrite MgFe23+4 est un spinelle inverse rare, dont les gisements sont liés à des formations volcaniques fumeroliennes (Vésuve).La franklinite ZnFe23+4 est un spinelle inverse, connu surtout à Franklin Furnace (New Jersey), dans les calcaires cristallins où il est associé à la zincite et à la willémite.Les spinelles chromifèresLes minéraux de la série chromifère ont comme formule générale:
C’est un minéral de haute température commun des roches métamorphiques. Il est souvent associé à la forstérité, au diopside, à la chondrodite et à la phlogopite dans les calcaires métamorphiques, à la cordiérite et aux orthopyroxènes dans les roches argileuses pauvres en silice ayant subi un métamorphisme thermique.HercyniteL’hercynite (Fe2+Al24) a des caractères cristallographiques analogues au spinelle proprement dit avec un paramètre a égal à 0,816 nm. Le système FeAl24 (hercynite)-Fe34 (magnétite) a été étudié expérimentalement par A.C. Turnock en 1959. Au-dessus de 858 0C, il existe une série complète de solutions solides; au-dessous de cette température, deux domaines d’exsolutions apparaissent.Les cristaux d’hercynite sont noirs et se trouvent dans des sédiments argileux métamorphisés plus riches en fer que ceux qui ont donné les pléonastes; on rencontre aussi ce minéral dans les bauxites ferrugineuses métamorphisées, dans des roches basiques et ultrabasiques. On peut également trouver de l’hercynite dans des granulites, ce spinelle ferreux étant stable en présence de silice libre, contrairement au spinelle alumineux magnésien. Les exsolutions d’hercynite dans la magnétite sont fréquentes dans des roches basiques.Gahnite et galaxiteLa gahnite ZnAl24 a une structure de spinelle normal. Il existe probablement une série complète de solutions solides entre ZnAl24 et MgAl24, donnant toutes les compositions que l’on trouve dans les gahnites des pegmatites granitiques ou dans les gîtes zincifères de Franklin (New Jersey) et de Falun (Suède).La galaxite Mn2+Al24 est un minéral rare associé à la téphroïte, à la rhodonite et aux oxydes de manganèse dans certains gisements manganésifères.Les spinelles ferrifèresMagnétiteLa magnétite Fe2+Fe23+4 a une structure du type «spinelle inverse» avec un paramètre a = 0,839 nm; sa formule structurale s’écrit donc, d’après la convention définie plus haut: Fe3+(Fe2+ 練 Fe3+)4.Les moments magnétiques des ions Fe3+ et Fe2+ sont respectivement 5 et 4 magnétons de Bohr. Tous les moments en site tétraédrique sont parallèles entre eux, ceux en site octédrique de même, et les études de diffraction neutronique ont montré que les moments magnétiques de cations en site tétraédrique et en site octaédrique sont antiparallèles suivant [111]. Autrement dit, le réseau des ions magnétogènes est subdivisé en deux sous-réseaux, aimantés en sens inverse, ceci confirme le travail de Néel en 1948. Si les moments étaient égaux dans les deux sous-réseaux, le moment résultant serait nul, et l’on aurait une substance antiferromagnétique. Dans le cas de la magnétite, le moment résultant est: face=F0019 轢5 (face=F0019 良4 練 良5) = 4 magnétons de Bohr, correspondant à une aimantation à saturation de 93 u.é.m. C.G.S.; c’est un ferrimagnétique typique dans le sens de L. Néel [cf. FERRITES ET GRENATS]. La température de Curie est de 578 0C, elle correspond au passage de l’ordre ferrimagnétique, à longue distance et température faible, au désordre quand la température augmente. Ce sont les deux propriétés fondamentales de cette espèce du point de vue magnétique.À l’état naturel, la magnétite pure est assez rare; plus généralement, on rencontre des magnétites substituées (des ions Fe2+ peuvent être remplacés par des ions Mg2+, des ions Fe3+ par Al3+ et Cr3+) et des solutions solides entre la magnétite et l’ulvöspinelle (titanomagnétites ), la magnétite et la maghémite (titanomaghémites ), la magnétite et la hausmannite. Les cristaux courants (cf. MINÉRALOGIE, pl. III) sont de faciès octaédriques111, mais, le plus souvent, la magnétite se présente en masses granulaires d’un noir de fer avec éclat submétallique, de densité 5,2 et de dureté 5.C’est un élément ubiquiste des roches ignées et métamorphiques. Dans les gîtes métallifères, elle existe en concentrations importantes dans les skarns à grenat, à pyroxènes et grenat (Magnitnaïa dans l’Oural) et en amas dans des séries métamorphiques (Kirunavaara en Suède).Les produits d’altération sont, suivant les conditions, la goethite, la lépidocrocite, la limonite, l’hématite ou la maghémite [cf. OXYDES ET HYDROXYDES NATURELS].UlvöspinelleL’ulvöspinelle Fe22+Ti4+4 est un spinelle du type inverse avec Fe2+ et Ti4+ remplaçant 2 Fe3+. On n’a pas observé jusqu’ici des cristaux isolés de ce minéral dans les roches et les minerais, mais il se présente en exsolutions, dans la magnétite, visibles seulement au microscope, aux forts grossissements (de l’ordre de 600). Sa première synthèse a été réalisé par T. Barth et E. Posnjak en 1932. Le paramètre de la maille varie suivant les auteurs, la valeur la plus probable étant 0,853 nm. L’ulvöspinelle est paramagnétique à 20 0C et devient antiferromagnétique aux basses températures, le point de Néel étant de 漣 150 0C. Ce minéral peut s’altérer en ilménite ou en un mélange de magnétite, d’ilménite et de fer.MaghémiteLa maghémite 塚Fe23 a, comme la magnétite, une structure de spinelle inverse. Le réseau des ions 2- est identique à celui des autres spinelles, ce qui conduit à écrire sa formule, en mettant 4 en évidence: Fe3+8/34; ou bien, en spécifiant les sites tétraédriques et octaédriques: Fe3+(Fe3+5/3 練 撚 1/3)4, le symbole 撚 indiquant une vacance. Le réseau est donc lacunaire, les sites vacants étant préférentiellement localisés dans les cavités octaédriques, d’après des études aux rayons X confirmées récemment par une diffraction neutronique. La maghémite est métastable et se transforme irréversiblement en hématite lorsqu’on la chauffe; cette température d’inversion, variable suivant les auteurs, semble dépendre de l’histoire antérieure de l’échantillon. Un point de Curie de 675 0C est obtenu en extrapolant les valeurs formées par des solutions solides stabilisées par la présence d’ions Na+. L’aimantation à saturation à 20 0C serait de 76 u.é.m. C.G.S. Le paramètre de la maille varie de 0,830 à 0,835 nm selon les auteurs.TitanomagnétitesLa magnétite et l’ulvöspinelle peuvent former une série complète de solutions solides à haute température. Cette série a été obtenue synthétiquement par divers chercheurs. On peut écrire sa constitution sous la forme x Fe2Ti4-(1 漣 x )Fe34. Plusieurs modèles coexistent actuellement concernant la distribution des cations. Les variations du paramètre de la maille et du point de Curie en fonction du pourcentage en molécules de Fe2Ti4 sont données sur la figure 2. Les dimensions de la maille augmentent linéairement en fonction du pourcentage en molécules de Fe2Ti4 depuis 0,840 nm (magnétite) jusqu’à 0,853 nm (ulvöspinelle).La composition chimique des titanomagnétites homogènes extraites des roches n’est pas toujours en accord avec la droite idéale des titanomagnétites synthétiques du diagramme ternaire des compositions moléculaires FeO, Fe23, Ti2 (fig. 3). Dans la majorité des cas, elle est comprise entre cette droite et la droite FeTi3-Fe23. Ces titanomagnétites se caractérisent par des sites vacants dans le réseau d’oxygène de structure «spinelle».Les titanomagnétites sont des constituants importants de certaines roches volcaniques, des gabbros et, d’une manière générale, des roches basiques et ultrabasiques. Le plus souvent, la teneur en Fe2Ti4 de la titanomagnétite d’une roche est d’autant plus élevée que la roche est plus basique.Magnésioferrite et frankliniteLa magnésioferrite MgFe23+4 est un spinelle inverse rare, dont les gisements sont liés à des formations volcaniques fumeroliennes (Vésuve).La franklinite ZnFe23+4 est un spinelle inverse, connu surtout à Franklin Furnace (New Jersey), dans les calcaires cristallins où il est associé à la zincite et à la willémite.Les spinelles chromifèresLes minéraux de la série chromifère ont comme formule générale: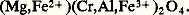 Leurs caractéristiques extérieures sont pratiquement identiques; aussi ne peut-on les différencier que par l’analyse chimique.Selon la composition, on distingue les composés définis idéaux: magnésiochromite MgCr24; ferrochromite , ou chromite sensu stricto (Fe2+, Mg) (Cr, Al, Fe3+)24. La classification proposée par G. A. Sokolov (1946) permet de situer tous les spinelles chromifères sur deux diagrammes accolés (fig. 4): sur le diagramme triangulaire sont notées les proportions moléculaires dans le groupe R23+3(Al23, Fe23, Cr23); sur le second, sont inscrites les proportions moléculaires dans le groupe (R2+O(FeO, MgO). Ainsi tout spinelle chromifère est représenté par deux points: les termes de picotite, chromite , par exemple, sont définis par le premier point (diagramme triangulaire); ils sont complétés par un préfixe ou un adjectif déterminé par la position du second point dans l’autre diagramme.Les chromospinelles se rencontrent presque exclusivement dans les roches ignées ultrabasiques (dunites, harzburgites, lherzolites) et les serpentines. Il existe une relation entre la composition du chromospinelle et la nature de la roche: les chromospinelles des dunites ont, en général, une teneur élevée en chrome et faible en aluminium; ceux des lherzolites ont une teneur faible en chrome et élevée en aluminium; les chromospinelles des harzburgites et werlhites ont une composition intermédiaire.Les spinelles chromifères constituant les minerais des gîtes contiennent plus de chrome et de magnésium et moins d’aluminium et de fer que les spinelles chromifères accessoires des roches encaissantes qui leur sont associées. Certaines météorites renferment des spinelles chromifères.La hausmanniteLa hausmannite Mn34, de groupe spatial I 4 1amd , a une structure de type «spinelle». Elle forme avec la magnétite Fe34, à température très élevée (supérieure à 1000 0C), une série de solutions solides qui peuvent se subdiviser en deux domaines: l’un de symétrie cubique, dont la composition varie de 0 à 60 p. 100 de Mn34 (la composition à 60 p. 100 de Mn34 correspondant à la jacobsite ); l’autre de symétrie tétragonale, allant de 60 p. 100 de Mn34 à la hausmannite. Le point de Curie de cette série décroît quand la teneur en Mn34 augmente, critère intéressant pour la diagnose. Ces minéraux se rencontrent dans certains gîtes pyrométasomatiques et hydrothermaux de manganèse comme Langban (Suède) et Vizigapatam (Inde).
Leurs caractéristiques extérieures sont pratiquement identiques; aussi ne peut-on les différencier que par l’analyse chimique.Selon la composition, on distingue les composés définis idéaux: magnésiochromite MgCr24; ferrochromite , ou chromite sensu stricto (Fe2+, Mg) (Cr, Al, Fe3+)24. La classification proposée par G. A. Sokolov (1946) permet de situer tous les spinelles chromifères sur deux diagrammes accolés (fig. 4): sur le diagramme triangulaire sont notées les proportions moléculaires dans le groupe R23+3(Al23, Fe23, Cr23); sur le second, sont inscrites les proportions moléculaires dans le groupe (R2+O(FeO, MgO). Ainsi tout spinelle chromifère est représenté par deux points: les termes de picotite, chromite , par exemple, sont définis par le premier point (diagramme triangulaire); ils sont complétés par un préfixe ou un adjectif déterminé par la position du second point dans l’autre diagramme.Les chromospinelles se rencontrent presque exclusivement dans les roches ignées ultrabasiques (dunites, harzburgites, lherzolites) et les serpentines. Il existe une relation entre la composition du chromospinelle et la nature de la roche: les chromospinelles des dunites ont, en général, une teneur élevée en chrome et faible en aluminium; ceux des lherzolites ont une teneur faible en chrome et élevée en aluminium; les chromospinelles des harzburgites et werlhites ont une composition intermédiaire.Les spinelles chromifères constituant les minerais des gîtes contiennent plus de chrome et de magnésium et moins d’aluminium et de fer que les spinelles chromifères accessoires des roches encaissantes qui leur sont associées. Certaines météorites renferment des spinelles chromifères.La hausmanniteLa hausmannite Mn34, de groupe spatial I 4 1amd , a une structure de type «spinelle». Elle forme avec la magnétite Fe34, à température très élevée (supérieure à 1000 0C), une série de solutions solides qui peuvent se subdiviser en deux domaines: l’un de symétrie cubique, dont la composition varie de 0 à 60 p. 100 de Mn34 (la composition à 60 p. 100 de Mn34 correspondant à la jacobsite ); l’autre de symétrie tétragonale, allant de 60 p. 100 de Mn34 à la hausmannite. Le point de Curie de cette série décroît quand la teneur en Mn34 augmente, critère intéressant pour la diagnose. Ces minéraux se rencontrent dans certains gîtes pyrométasomatiques et hydrothermaux de manganèse comme Langban (Suède) et Vizigapatam (Inde).
Encyclopédie Universelle. 2012.
